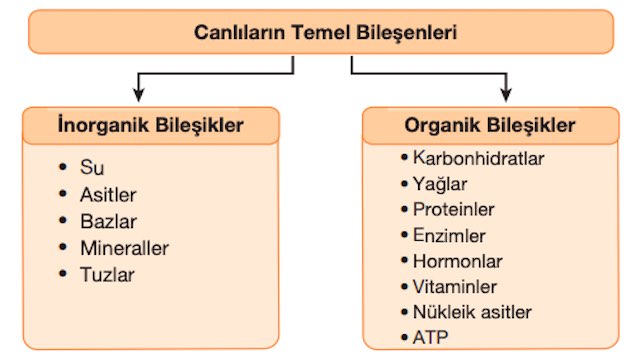
Canlıların yapısında bulunan bileşikler inorganik ve organik olmak üzere ikiye ayrılır. Canlı hücreler doğadan aldıkları bu maddeleri doğrudan kullanabildiği gibi bu maddelerin yapısını değiştirerek kendine özgü bir forma da dönüştürebilir.
İnorganik maddelerin genel özellikleri nelerdir
• İnorganik bileşikler genellikle karbon atomu içermeyen moleküllerdir.
• Canlılar inorganik maddeleri vücutlarında üretemedikleri için doğadan hazır olarak alırlar.
• Küçük yapılı olduklarından sindirime uğramadan hücre zarından geçebilirler. Solunum tepkimelerinde enerji verici olarak kullanılmazlar.
• Hücrelerin yapısına katılabildiği gibi metabolik faaliyetlerin düzenlenmesi ve yıpranan dokuların onarılması gibi olaylarda da görev alırlar.
İnorganik Bileşikler Nelerdir
A. Su
* Canlıların temel maddelerinden olan su, hücrelerimizin büyük bir kısmını oluşturur. Miktarı canlıdan canlıya değişebileceği gibi aynı canlının farklı dokularında bile farklılık gösterebilir. İnsanlarda kan plazmasının % 90′ ı sudan oluşurken, kemik dokuda bu oran % 20′ lere kadar düşebilir.
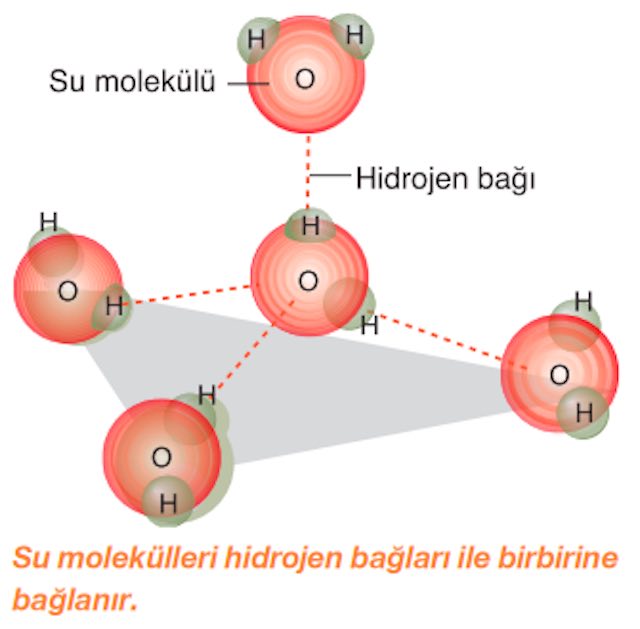
* Su iki hidrojen ve bir oksijen atomundan oluşur. Nötr bir molekül olan suyun (+) yüklü hidrojen atomları ile (–) yüklü oksijen atomları arasında bir çekim kuvveti oluşur. Aşağıda suyun bazı özellikleri ve canlılar için önemi belirtilmiştir.
* Kohezyon kuvveti ve yüzey gerilimi: Su molekülleri hidrojen bağları ile birbirine bağlanarak bir arada kalırlar. Bu durum kohezyon olarak adlandırılır. Suyun farklı bir moleküle tutunmasına ise adhezyon denir. Suyun bitkilerin odun borularının duvarlarına tutunması bir adhezyon örneğidir. Bitkiler suyun bu iki
özelliğini kullanarak topraktan aldıkları suyu yerçekimine zıt yönde taşıyarak yapraklarına ulaştırır. Suyun yüzeydeki molekülleri arasında oluşan kuvvete yüzey gerilimi denir. Bazı böcekler bu özelliği kullanarak su üzerinde yürüyebilir.
Suyun Özgül ısısının yüksek olması
Su sıcak havadaki ısıyı soğurur ve kendi içinde depolanmış ısıyı daha soğuk olan havaya verir. Bu özelliği sayesinde su, hava sıcaklıklarını kararlı hale getirir ve bir ısı bankası olarak görev yapar. İnsan vücudunun sıcaklığının belirli sınırlar içinde sabit kalmasında suyun bu özelliği önemli görev yapar.
Suyun Buharlaşması
Suyun sıvı halden gaz haline geçmesi buharlaşma olarak adlandırılır. Suyun buharlaşabilmesi için belirli miktarda ısıyı soğurması gerekir. Bu nedenle terleme vücuttan su ile beraber bir miktar ısıyı da uzaklaştırır. Böylece vücut ısısının yükselmesi engellenmiş olur.
Suyun Çözücü özelliği
Su bir çok reaksiyonda çözücü olarak görev yapar. Bu özelliğinden dolayı su kanda madde taşınımı, metabolik atıkların seyreltilmesi, atılımı ve besinlerin sindirimi gibi birçok olaya yardımcı olur.
Suyun Donma özelliği
Soğuk havalarda göl, gibi su kütlelerinin yüzeyleri donar. Buzun yoğunluğu suya göre az olduğundan buz dibe batmaz ve suyun yüzeyinde kalır. Yüzen buz kütleleri alttaki suyu yalıtarak onun donmasını önler. Böylece donan su yüzeyinin altında canlıların yaşaması mümkün olur.
B. Asitler
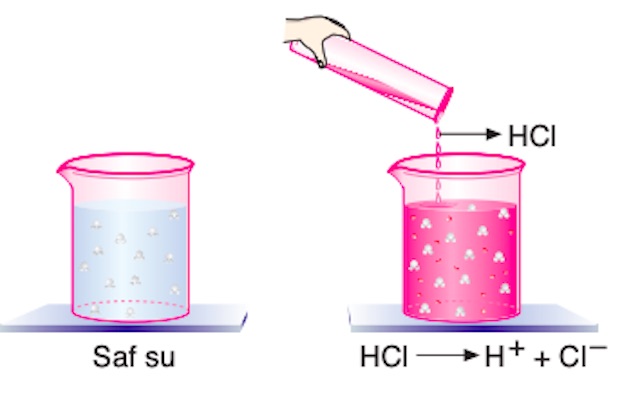
Bir çözeltinin hidrojen iyonu (H+) derişimini artıran bileşikler asit olarak adlandırılır. Asitler mavi turnusol kağıdını kırmızıya çevirir. Laktik asit organik, hidroklorik asit (HCl) inorganik asitlere örnektir.
Saf suya dökülen hidroklorik asit H+ ve Cl– iyonlarına ayrışır. H+ iyonu derişiminin artması çözeltiyi asidik hale getirir.
C. Bazlar
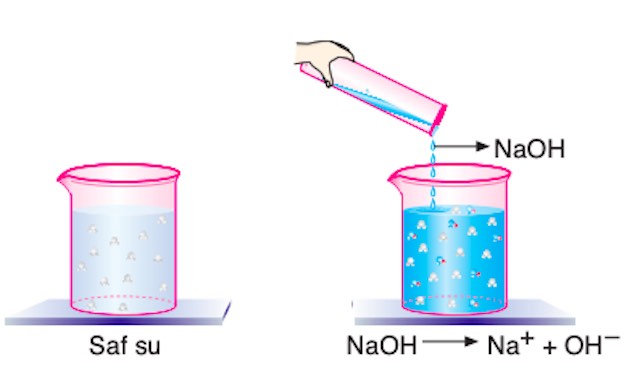
Suda çözündüklerinde hidroksil iyonu (OH–) veren maddelere baz denir. Bazlar kırmızı turnusol kağıdını maviye çevirir. Metilamin organik bazlara, sodyum hidroksit (NaOH) ise inorganik bazlara örnektir.
Saf suya dökülen sodyum hidroksit Na+ ve OH– iyonlarına ayrışır. OH– iyonunun derişiminin artması çözeltiyi bazik hale getirir.
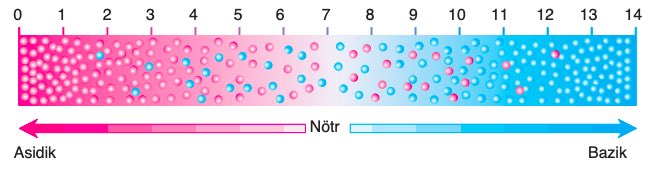
pH Cetveli: Bir çözeltinin asitlik ve baziklik derecesini ölçmek için, hidrojen (H+) iyonunun derişiminin bir ölçümü olan pH cetvelinden yararlanılır. pH cetveli 0–14 arasındadır. pH’ın 7 olması çözeltinin nötr olduğunu ifade eder. pH 7′ den 0’a gidildikçe asitlik artar. pH 7’den 14’e gidildikçe ise baziklik artar.
Vücudumuzda hücre içi ve dışı sıvıların pH’ının belirli sınırlar içinde kalması çok önemlidir. Çünkü biyolojik moleküller (enzim gibi), pH değişimlerinden çok çabuk etkilenir. Bu nedenle vücudumuzda pH’ın sabit kalmasını dengeleyen mekanizmalar gelişmiştir.
Tampon Çözeltiler: Asit karşısında baz, baz karşısında asit gibi davranarak sulu çözeltilerin pH değerinin değişmesini önleyen çözeltilere tampon çözelti denir.
Kanımızın pH’ı 7,4 civarındadır. Kan pH’sı 7 ye düşen ya da 7,8’e yükselen bir insan birkaç dakikadan fazla hayatta kalamaz. Kanda bulunan karbonik asit (H2CO3) gibi tamponlar, pH’ daki dalgalanmaları önler. Kandaki asitlik azalırsa karbonik asit hidrojen (H+) ve bikarbonat HCO– 3 ^ h iyonlarına ayrışır. Artan H+ iyonları kandaki asitliği artırarak normale dönmesini sağlar.
Kandaki asitlik artarsa bikarbonat iyonları fazla olan hidrojen iyonlarını kendine bağlar ve asitlik azalarak normale döner.
D. Mineraller
Organizmanın yapısında az bulunmasına rağmen, canlılığın sürdürülmesi için gerekli olan maddelerdir. Hücrenin yapısına katılabildiği gibi düzenleyici olarak da görev yapabilirler. Canlı vücudunda sentezlenemedikleri için tüm canlılar mineral ihtiyacını doğadan karşılar. Mineral eksikliği hastalıkların oluşmasına neden olur.
E. Tuzlar
Asitlerle bazlar birleşerek tuzları oluşturur. Asitler bazlar ile karıştırıldığında asidin H+ iyonu ile bazın OH– iyonu birleşip su açığa çıkar. Asit ve bazların yapısındaki diğer iyonların birleşmesiyle de tuzlar oluşur. Hücrelerde ve hücreler arası sıvılarda çeşitli mineral tuzları bulunur. Tuzlar sıvı ortamda anyon ve katyonlarına ayrılır. Klor (Cl–) ve bikarbonat HCO– 3 ^ h anyonlara, sodyum (Na+) ve kalsiyum (Ca++) katyonlara örnek olarak verilebilir.